Η χημική εξίσωση μιας εξουδετέρωσης μπορεί να γραφεί με τους παρακάτω διαφορετικούς τρόπους.
1ος τρόπος:
Γράφεταιί η χημική εξίσωση της αντίδρασης ώστε να φαίνονται απλά, τα αντιδρώντα και τα προϊόντα της αντίδρασης. Η εξίσωση αυτής της μορφής είναι γνωστή ως μοριακή χημική εξίσωση και για την περίπτωση της αντίδρασης του υδροχλωρικού οξέος με το καυστικό νάτριο είναι:

2ος τρόπος
Ο δεύτερος τρόπος που μπορεί να γραφεί μια χημική εξίσωση βασίζεται στο γεγονός ότι πολλές χημικές ενώσεις που συμμετέχουν στην αντίδραση είτε ως προϊόντα είτε ως αντιδρώντα στην πραγματικότητα υπάρχουν μόνο ως ιόντα στα υδατικά διαλύματα.
Επομένως στην περίπτωση αυτή, γράφονται οι ενώσεις αυτές, στη χημική εξίσωση μιας αντιδράσης, με την πραγματική τους μορφή δηλαδή με τη μορφή ιόντων. Έτσι το ΗCl (aq) γράφεται ως H + (aq ) και Cl - (aq) και το NaCl (aq) ως Na + (aq) και C l- (aq) . Έτσι προκύπτει μια πλήρης ιοντική εξίσωση:
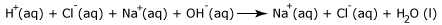
Στην παραπάνω ιοντική εξίσωση τα ιόντα Na + (aq) και Cl - (aq) εμφανίζονται τόσο στα αντιδρώντα όσο και στα προϊόντα. Τα ιόντα αυτά δε συμμετέχουν στην αντίδραση, είναι απλοί θεατές και μπορούν να διαγραφούν από τα αντιδρώντα και τα προϊόντα.
Έτσι προκύπτει η τελική ιοντική εξίσωση:
![]()
όπου φαίνεται ότι η εξουδετέρωση δεν είναι τίποτε άλλο παρά η αντίδραση των κατιόντων υδρογόνου και των ανιόντων υδροξειδίου προς παραγωγή νερού.
Με ανάλογο τρόπο για την εξουδετέρωση θειικού οξέος και υδροξειδίου του νατρίου ισχύουν τα εξής:
Μοριακή εξίσωση:
![]()
Πλήρης ιοντική εξίσωση:
![]()
Τελική ιοντική εξίσωση:
![]()
και μετά τη διαίρεση με 2:
![]()
Από τις παραπάνω χημικές εξισώσεις προκύπτει ότι ανεξάρτητα από το είδος του οξέος και της βάσης που εξουδετερώνονται η τελική χημική εξίσωση είναι πάντα η ίδια.
Βέβαια, αν για οποιαδήποτε εξουδετέρωση δίνεται μόνο η τελική ιοντική εξίσωση ο αναγνώστης δε μπορεί να γνωρίζει ποιο οξύ και ποια βάση αντέδρασαν. Έτσι, πολλές φορές οι εξισώσεις εξουδετέρωσης γράφονται και με τη μοριακή τους μορφή.