Η αλληλουχία των αμινοξέων μιας πρωτεΐνης είναι χαρακτηριστική για τη συγκεκριμένη πρωτεΐνη και καλείται πρωτοταγής δομή. Πρόκειται για ένα από τα τέσσερα βασικά επίπεδα οργάνωσης της πρωτεϊνικής δομής. Η πρωτοταγής δομή μιας πρωτεΐνης (ή ενός πεπτιδίου) καθορίζεται από μια συγκεκριμένη αλληλουχία νουκλεοτιδίων των αλυσίδων DNA.
Ένα παράδειγμα πρωταγούς δομής αποτελεί η αλληλουχία της πολυπεπτιδικής αλυσίδας της λυσοζύμης, ενός βακτηριολυτικού ενζύμου που υπάρχει στα δάκρυα και στο ασπράδι του αυγού. Η λυσοζύμη από το ασπράδι του αυγού της όρνιθας αποτελείται από 129 κατάλοιπα αμινοξέων.
Αν απομονώσουμε ένα τμήμα της δομής αυτής και συγκεκριμένα αυτό πoυ περιέχει τα αμινοξέα 38 έως 47, προκύπτει ένα πεπτίδιο 10 καταλοίπων, στο οποίο μπορούμε να δούμε τη γραμμική αλληλουχία των καταλοίπων που χαρακτηρίζει την πρωτοταγή του δομή.
Η ύπαρξη των καταλοίπων κυστεΐνης στην αλληλουχία της λυσοζύμης είναι σημαντική. Το αμινοξύ κυστεΐνη οξειδώνεται και ανάγεται μέσω της σουλφυδρυλικής ομάδας -SH. Η οξείδωση δύο σουλφυδρυλικών ομάδων οδηγεί στο σχηματισμό ενός δισουλφιδικού δεσμού από την αφαίρεση δύο υδρογόνων. Η ένωση ονομάζεται κυστίνη. Αυτή η τροποποίηση εμφανίζεται συχνότερα στις εξωκυτταρικές πρωτεΐνες και σταθεροποιεί την τρισδιάστατη δομή τους.
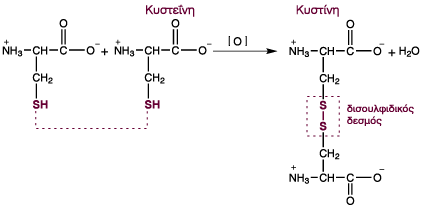
Ο δισουλφιδικός δεσμός της κυστίνης μπορεί να συνδέσει δύο τμήματα στην ίδια πρωτείνη ή σε διαφορετικές πρωτείνες.
Στην αλληλουχία της λυσοζύμης υπάρχουν:
- 8 κατάλοιπα κυστεΐνης στις θέσεις 6, 30, 64, 76, 80, 94, 115 και 127.
- 4 δισουλφιδικοί δεσμοί μεταξύ των κυστεϊνών αυτών 6-127, 30-115, 164-80 και 76-94.