Ο όρος δευτεροταγής δομή αναφέρεται σε ευδιάκριτο μοντέλο πτύχωσης κάποιου τμήματος του πολυπεπτιδικού σκελετού μιας πρωτεΐνης. Μερικές πτυχώσεις δευτεροταγούς δομής είναι ιδιαίτερα σταθερές και ευρέως διαδεδομένες στις πρωτεΐνες.
Οι πιο κοινές δευτεροταγείς δομές είναι η α-έλικα, η β-πτυχωτή επιφάνεια και οι β στροφές. Οι δομές αυτές προκύπτουν από τη σύνδεση με δεσμούς υδρογόνου των ομάδων >N-H και >C=O του πολυπεπτιδικού σκελετού χωρίς τη συμμετοχή των πλευρικών αλυσίδων των αμινοξικών καταλοίπων.
Η α-έλικα έχει τη μορφή σπείρας ενός ελατηρίου και είναι δεξιόστροφη με 3,6 κατάλοιπα ανά στροφή. Σταθεροποιείται από τους δεσμούς υδρογόνου μεταξύ της ομάδας >N-H κάθε πεπτιδικού δεσμού και της ομάδας >C=O ενός γειτονικού πεπτιδικού δεσμού που βρίσκεται στην ίδια αλυσίδα, σε απόσταση 4 αμινοξέων. Στις παρουσιάσεις κορδέλας, οι α-έλικες αναπαρίστανται με σπειροειδείς κορδέλες ή κυλίνδρους. Ένα παράδειγμα πρωτεΐνης με α-έλικα είναι η λυσοζύμη:
α-έλικα Λυσοζύμης: Δεσμοί υδρογόνουΗ σπείρα θεωρείται ότι περικλείει τον πολυπεπτιδικό σκελετό. Οι πλευρικές αλυσίδες επεκτείνονται εξωτερικά από τη σπείρα και είναι διαθέσιμες για αλληλεπίδραση με το υδατικό περιβάλλον, άλλα μέρη της πρωτεΐνης ή άλλα μακρομόρια.
α-έλικα Λυσοζύμης: Πλευρικές αλυσίδεςΤο κύριο κριτήριο για το σχηματισμό α-ελίκων είναι ότι η πλευρική αλυσίδα ενός αμινοξέος πρέπει να καλύψει και να προστατεύσει τους δεσμούς-Η του πολυπεπτιδικού σκελετού στον εσωτερικό (πυρήνα) της έλικας. Τα αμινοξέα που μπορούν να συμβάλλουν σε αυτό είναι: Ala, Leu, Met, Phe, Glu, Gln, His, Lys, Arg
Η β-πτυχωτή επιφάνεια είναι συμπαγής και σταθερή δομή. Σ΄αυτήν δύο ή περισσότερα ευθύγραμμα τμήματα της πολυπεπτιδικής αλυσίδας, που ονομάζονται β κλώνοι, τοποθετούνται το ένα δίπλα στο άλλο και σε σχετική θέση τέτοια που να ευνοείται ο σχηματισμός ενδομοριακών δεσμών υδρογόνου μεταξύ των καρβονυλικών οξυγόνων και των αμιδικών υδρογόνων των πολυπεπτιδικών σκελετών τους.
Η εκτεταμένη αυτή δομή αφήνει το μέγιστο ελεύθερο χώρο για τις πλευρικές αλυσίδες αμινοξέων. Κατά συνέπεια, τμήματα των πρωτεϊνών με κατάλοιπα αμινοξέων με μεγάλες ογκώδεις πλευρικές αλυσίδες προτιμούν να υιοθετούν δευτεροταγή δομή β-πτυχωτής επιφάνειας.
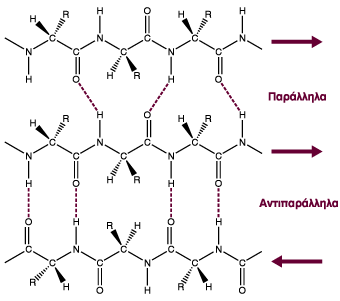
Όπως και στην α-έλικα, οι πλευρικές αλυσίδες των αμινοξέων κάθε β κλώνου προβάλλουν εναλλάξ πάνω και κάτω από το επίπεδο της β-πτυχωτής επιφάνειας και είναι ελεύθερες να αλληλεπιδράσουν με το περιβάλλον. Ο σχετικός προσανατολισμός των ευθυγράμμων αυτών τμημάτων μπορεί να είναι παράλληλος (με την ίδια φορά) ή αντιπαράλληλος (με αντίθετη φορά), εώ είναι δεξιόστροφα ή και αριστερόστροφα (πολύ σπάνια).
Στις παρουσιάσεις κορδέλας, οι περιοχές με διαμόρφωση β-πτυχωτής επιφάνειας αναπαρίστανται με κορδέλες που έχουν στο άκρο βέλος ή επίπεδα βέλη. Τα βέλη δείχνουν προς το ίδιο C-τελικά άκρο κάθε β κλώνου.
Στη διάταξη αυτή οι β κλώνοι προσανατολίζονται παράλληλα και τα Ν-τελικά και C-τελικά άκρα βρίσκονται στην ίδια πλευρά. Ένα παράδειγμα πρωτεΐνης με παράλληλες β-πτυχωτες επιφάνειες είναι το ένζυμο Καρβοξυπεπτιδάση Α που βρίσκεται στο πάνγκρεας του βοδιού:
Παράλληλη β-πτυχωτή επιφάνεια: Δεσμοί Υδρογόνου
Παράλληλη β-πτυχωτή επιφάνεια: Πλευρικές αλυσίδες
Στη διάταξη αυτή οι β κλώνοι προσανατολίζονται αντιπαράλληλα με τα N-τελικά και C-τελικά βρίσκονται σε αντίθετες πλευρές. Παραδείγματα ντιπαρράλληλων β-πτυχωτών επιφανείών αποτελούν τα κατάλοιπα 42-46 και 50-53 της λυσοζύμης:
Αντιπαράλληλη β-πτυχωτή επιφάνεια: Δεσμοί υδρογόνου
Αντιπαράλληλη β-πτυχωτή επιφάνεια: Πλευρικές αλυσίδες
Οι αντιπαράλληλες β-πτυχωτές επιφάνειες είναι σε σημαντικό βαθμό πιο σταθερές δομές λόγω των καλά ευθυγραμμισμένων δεσμών υδρογόνου.
Τα αμινοξέα που ευνοούν το σχηματισμό β-πτυχωτών επιφανειών είναι αυτά με μεγάλη πλευρική αλυσίδα (Tyr, Trp, Phe, Met)) ή ογκώδη λόγω του διακλαδισμένου β άνθρακα (Ile, Val, Thr) ή λόγω του ατόμου του S στο β άνθρακα (Cys).
Οι β στροφές ενώνουν τα άκρα δύο γειτονικών τμημάτων των αντιπαράλληλων β-πτυχωτών επιφανειών. Η δομή είναι μία στροφή 180ο που περιλαμβάνει 4 κατάλοιπα αμινοξέων, με το οξυγόνο του καρβονυλίου στο πρώτο αμινοξύ να σχηματίζει δεσμό υδρογόνου με το υδρογόνο του τέταρτου αμινοξέος. Οι πεπτιδικές ομάδες των δύο κεντρικών αμινοξέων δε συμμετέχουν σε κανένα δεσμό υδρογόνου.
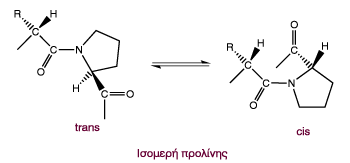
Στις β στροφές συχνά υπάρχουν γλυκίνη (Gly) και προλίνη (Ρro), η πρώτη επειδή είναι μικρή κι ευλύγιστη, ενώ η δεύτερη επειδή οι πεπτιδικοί δεσμοί στους οποίους συμμετέχει το άζωτο της ιμινομάδας της υιοθετούν cis-διαμόρφωση, η οποία προσφέρεται για το σχηματισμό μιας κλειστής στροφής.
Διαφορετικά είδη στροφών στην αλυσίδα ταξινομούνται επίσης ως δευτεροταγείς δομές. Έτσι το κολλαγόνο, που είναι η πιο διαδεδομένη πρωτεΐνη στο σώμα του ανθρώπου, σχηματίζει μια έλικα με γεωμετρικά χαρακτηριστικά διαφορετικά από εκείνα της α-έλικας. Αυτό οφείλεται στη σημαντική συμμετοχή, 20% περίπου, της προλίνης που δεν επιτρέπει την ομαλή εξέλιξη της α-έλικας.
Η α-αλυσίδα του κολλαγόνου είναι αριστερόστροφη και έχει μοναδική επαναλαμβανόμενη δευτεροταγή δομή (Gly-X-Pro ή Gly-X-4-Hyp) με 3 κατάλοιπα ανά στροφή. Η επαναλαμβανόμενη αλληλουχία που χρησιμοποιήθηκε για να δημιουργηθεί αυτό το μοντέλο είναι Gly- Pro -4-Hyp.
Τα τμήματα των πολυπεπτιδικών αλυσίδων που δεν ανήκουν σε μια ταξινόμηση (α-έλικες , β-πτυχωτές επιφάνειες και β-στροφές) αποτελούνται από ακανόνιστα σπειροειδείς (στροφές ή θηλιές) ή εκτεταμένες περιοχές. Περίπου 50% όλων των πρωτεϊνικών δομών ανήκουν σε αυτήν την κατηγορία.
Τυχαία διαμόρφωση Λυσοζύμης του ασπραδιού του αυγού
Τα κατάλοιπα αμινοξέων που απαντώνται συνήθως σε αυτές τις περιοχές είναι του απαραγινικού (Asp), της ασπαραγίνης (Asn) και της σερίνης (Ser), τα οποία ανταγωνίζονται άμεσα τους δεσμούς υδρογόνου του πολυπεπτιδικού σκελετού. Οι τυχαίες διαμορφώσεις συνδέουν τις δευτεροταγείς δομές και χαρακτηρίζουν τα όριά τους.