- Εισαγωγή: Η ιστορική πορεία της ολοκλήρωσης της δομής του ατόμου
- Το άτομο και η διακριτότητα της ύλης
- Οι ατομιστικές αντιλήψεις στη διάρκεια των μέσων χρόνων
- H Eπανεμφάνιση του Aτόμου
- Το ξεκίνημα της σύγχρονης ατομικής θεωρίας
- Αρχικές αντιδράσεις και τελική εδραίωση της ατομικής θεωρίας
- Η διερεύνηση της δομής του ατόμου
Το ξεκίνημα της σύγχρονης ατομικής θεωρίας
John Dalton
Tο άτομο επανήλθε στην επιστημονική ορολογία σαν οντότητα, στην αρχή του 18ου αιώνα, με την ατομική θεωρία του John Dalton (1766-1844). Aκόμη και σήμερα, ο ορισμός που διδάσκεται στα σχολεία της μέσης εκπαίδευσης, είναι εκείνος που αναφέρεται από τον Dalton το 1808.
"Διάλεξα τη λέξη άτομο για να αποδώσει τα ελάχιστα σωματίδια, αντί για τις αντίστοιχες λέξεις σωματίδιο, μόριο ή οτιδήποτε άλλο, επειδή πιστεύω πως αυτή είναι πιο εκφραστική, αφού εμπεριέχει την έννοια της αδιαιρετότητας την οποία οι άλλες δεν εμπεριέχουν. Mπορεί να φανεί ότι επεκτείνω αρκετά τον ορισμό όταν μιλάω για σύνθετα άτομα. Oνομάζω το στοιχειώδες σωματίδιο του ανθρακικού οξέος ως σύνθετο άτομο. Aυτό το άτομο, μπορεί φυσικά να διαιρεθεί, αλλά τότε παύει να είναι πλέον άτομο ανθρακικού οξέος, αφού έχει αναλυθεί σε άνθρακα και οξυγόνο. Mε την έννοια αυτή θεωρώ ότι δεν υπάρχει ανακολουθία όταν αναφέρομαι σε σύνθετα άτομα και αυτό που εννοώ γίνεται σαφές."

Δεν είναι φανερό από τον ορισμό αυτό, όπως και από τα υπόλοιπα κείμενα του, αν ο Dalton αντιμετώπιζε τα απλά άτομα σαν αδιαίρετα, δηλαδή σαν το φυσικό τέλος της διαδικασίας ανάλυσης της ύλης. Φαίνεται ωστόσο πως η διαίρεση παραπέρα, σε "τεμάχια" που να μην έχουν πια τις χημικές ιδιότητες των αντίστοιχων στοιχείων, δεν αντιβαίνει κατά κανένα τρόπο στη διατύπωση των απόψεών του γι' αυτά.
Είναι πάντως αντιληπτό ότι θεωρούσε πως κάθε στοιχείο είχε ένα συγκεκριμένο είδος ατόμου διαφορετικό από τα άτομα κάθε άλλου στοιχείου. Αυτό σήμαινε ότι για τα περίπου 40 γνωστά τότε στοιχεία έπρεπε να υπάρχουν 40 διαφορετικά άτομα ως βασικά συστατικά σ' όλα τα σώματα. Τέλος, τα μόρια τα χαρακτήριζε επίσης άτομα αλλά τα ονόμασε «σύνθετα άτομα» compound atoms, όρος που έχει παραμείνει ως σήμερα όπου όλοι αναφερόμαστε στις χημικές ενώσεις με τον όρο compounds.
Ένα από τα προβλήματα που ο ίδιος ο Dalton δημιούργησε ήταν η αναμενόμενη μεν πλην απλουστευτική θέση πως δύο στοιχεία, Α και Β, που αλληλεπιδρούν θα σχηματίσουν κατ' ανάγκην την ένωση Α-Β ενώ έπρεπε να έχει στη διάθεσή του πολλά δεδομένα για να συνηγορήσει στη δυνατότητα σχηματισμού μιας «τριμερούς» ή ανώτερης τάξης ένωσης, όπως π.χ. Α2 Β ή ΑΒ2. Έτσι, για τον Dalton τα γνωστά μας μόρια του νερού και της αμμωνίας θα είχαν τον συμβολισμό OH και ΝΗ αντίστοιχα.
Παρόλα αυτά ο Dalton ήταν ο πρώτος που πρότεινε μια μεθοδολογία με βάση την οποία μπορούσε να προσεγγιστεί ο μικρόκοσμος. Αφού πρότεινε την κλίμακα σχετικών βαρών των στοιχείων, προφανώς παρέκαμπτε την ανάγκη να επιχειρεί μια απευθείας μέτρηση της εξαιρετικά μικρής μάζας του κάθε ατόμου αλλά μπορούσε να υπολογίσει, με βάση μακροσκοπικά αναλυτικά δεδομένα, τον λόγο των μαζών των στοιχείων σε κάθε ένωση. Με βάση την προηγούμενη παρατήρηση, γίνεται αντιληπτό ότι η κλίμακα ατομικών βαρών που εισηγήθηκε είναι εσφαλμένη με τα σημερινά δεδομένα, η όλη όμως σύλληψη συνετέλεσε πολύ στην ανάπτυξη της επιστήμης της Χημείας.
| Στοιχείο | Έτος | ||
| 1803 | 1808 | 1810 | |
| Η | 1 | 1 | 1 |
| Ν | 4,2 | 5 | 5 |
| C | 4,3 | 5 | 5,4 |
| O | 5,5 | 7 | 7 |
| P | 7,2 | 9 | 9 |
| S | 14,4 | 13 | 13 |
| Fe | 38 | 50 | |
| Zn | 56 | 56 | |
| Cu | 56 | 56 | |
| Pb | 95 | 95 | |
Με βάση λοιπόν αναλυτικά δεδομένα του Gay-Lussac για το νερό, και γνωρίζοντας ότι κατά μέσον όρο αυτά έδιναν εκατοστιαία αναλογία οξυγόνου και υδρογόνου 84,7% και 12,6% και θεωρώντας ως μονάδα τη σχετική μάζα του ελαφρύτερου των ατόμων, του υδρογόνου, πρότεινε ως σχετικό ατομικό βάρος για το οξυγόνο το 7. Τα δεδομένα του μεταβαλλόταν με τον χρόνο όπως μεταβαλλόταν και τα σχετικά αναλυτικά δεδομένα και σε διάφορες χρονικές στιγμές παρουσίασε διάφορους πίνακες σχετικών βαρών τα οποία είναι εμφανές πως είχε την τάση να τα «στρογγυλέψει» κατά το δυνατόν. Ένα μικρό δείγμα από τα δεδομένα αυτά παρουσιάζεται στον διπλανό πίνακα.
Ένα ακόμη βήμα της ατομικής θεωρίας του Dalton ήταν η αντίληψη περί της αφθαρσίας των ατόμων τα οποία μεταφερόταν από ένωση σε ένωση κατά την πορεία των αντιδράσεων και με την έννοια αυτή μπορεί να θεωρηθεί ότι η πρότασή του αποτελεί ένα πρόδρομο της διατύπωσης της χημικής εξίσωσης για μια αντίδραση.
Εκείνο που δυσκόλευε την όλη διαδικασία ήταν το αλχημιστικό κατάλοιπο του συμβολισμού των ατόμων.
Ο Dalton δεν πρότεινε κάτι απλό που θα βοηθούσε την προσέγγιση της ατομικής του θεωρίας από πολλούς, όπως φαίνεται και στο επόμενο σχήμα ο κάθε κύκλος περιείχε ένα είδος διαγράμμισης που δεν βοηθούσε στην απομνημόνευση ούτε στη διάδοση των χημικών αντιδράσεων.
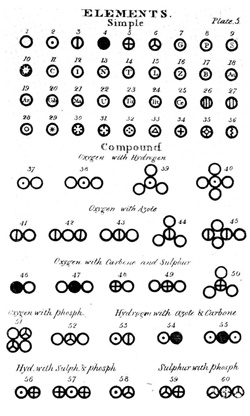
Φυσικά μερικά σημεία ήταν σχετικά απλό να προσεγγιστουν από τον Dalton αφού ήδη αποτελούσαν κεντιρκό και αναμφισβήτητο κομμάτι της χημικής γνώσης από την εποχή του Lavoisier. Ήταν δηλαδή κατανοητό ότι οι χημικές ενώσεις αποτελούνταν από συνδυασμούς χημικών στοιχείων, τα οποία ήταν αδύνατο να διασπαστούν παραπέρα σε απλούστερα συστατικά. Επίσης η αρχή της αφθαρσίας υπεδείκνυε ότι τα βάρη των στοιχείων μεταφέρονταν αυτούσια από ένωση σε ένωση κατά την πορεία των χημικών αντιδράσεων.
Ο ίδιος ο Dalton είχε εργαστεί και είχε δώσει θετικά αποτελέσματα στον τομέα αυτό με τις παρατηρήσεις του πάνω στη σύσταση των χημικών ενώσεων που είναι γνωστές με τη μορφή του νόμου των σταθερών αναλογιών.
Προφανώς κι εκεί είχε προηγηθεί η εξαιρετική αποδεικτική δουλειά του Proust που είχε καταδείξει ότι τα βάρη με τα οποία τα χημικά στοιχεία συμμετείχαν σε μια ένωση ήταν ανεξάρτητα της φυσικής κατάστασης της ένωσης ή των εξωτερικών συνθηκών κατά την ώρα της μέτρησης καθώς και ανεξάρτητα από την πειραματική διαδικασία παρασκευής της ένωσης.
Στηριγμένος στα παραπάνω μπόρεσε ο Berzelius να προχωρήσει στην απεικόνιση της ατομικής θεωρίας του Dalton με τη συμβολική μορφή των χημικών τύπων των ενώσεων.
Σημαντικό στοιχείο της θεωρίας ήταν η δυνατότητα για σχετικά ακριβείς προβλέψεις με βάση τους σχετικούς νόμους που προαναφέρθηκαν σχετικά με τη σύσταση των ενώσεων. Για παράδειγμα, ο λεγόμενος νόμος των πολλαπλών αναλογιών όπως προτάθηκε από τον Dalton και επιβεβαιώθηκε πειραματικά προτείνει πως αν δυο στοιχεία Α και Β ενώνονται με ένα στοιχείο Γ και σχηματίζουν ενώσεις στις οποίες τα βάρη τους είναι χ και ψ ως προς το ίδιο βάρος του Γ, τότε αν ενωθούν μεταξύ τους για να σχηματίσουν ένωση, ο λόγος των βαρών τους στην ένωση αυτή θα είναι χ/ψ. Κατ αντιστοιχία αλλά χωρίς τη βαρύτητα της παραπάνω πρότασης, υπήρξε η πειραματική επιβεβαίωση από τον Gay-Lussac ότι η ένωση αερίων για σχηματισμό ενώσεων πραγματοποιείται με όγκους που έχουν μεταξύ τους αναλογία ακεραίων αριθμών.
Φυσικά την εποχή εκείνη πολύ λίγα ήταν τα γνωστά και χαρακτηρισμένα αέρια και για το λόγο αυτό η συγκεκριμένη πρόταση δεν είχε ευρεία εφαρμογή.
H συμβολική γλώσσα της χημείας
Στον Jons Jackob Berzelius (1770-1848) οφείλεται, σε μεγάλο βαθμό, ο καθορισμός των συμβόλων των ατόμων με τη μορφή που είναι γνωστά σήμερα, ιδιαίτερα η πρόταση για χρήση και δεύτερου γράμματος, εφόσον ορισμένα στοιχεία είχαν το αυτό αρχικό. (π.χ. C= Carbon, Cl= Chlorine, Cs= Caesium, Cr= chromium κλπ.
Στη συγκεκριμένη περίπτωση, ο άνθρακας, λόγω της αρχαιότητάς του ή λόγω της εκτεταμένης συμμετοχής ενώσεών του στον έμβιο κόσμο διατήρησε το προνόμιο του μοναδικού αρχικού γράμματος). Αυτός όμως είχε την τάση να συμβολίζει τα άτομα οξυγόνου ως τελείες δίπλα στα άτομα με τα οποία το οξυγόνο σχημάτιζε ένωση, ενώ για να δηλώσει την παρουσία δύο ή περισσότερων ατόμων Α σε μια ένωση χρησιμοποιούσε ένα σύνθετο σύμβολο με μια ή περισσότερες οριζόντιες γραμμές να διαπερνούν το σύμβολο του Α. Έτσι, το μόριο Η2Ο για παράδειγμα το συμβόλιζε ως.


Ωστόσο πρότεινε την κατά σειρά καταγραφή των διαφορετικών ατόμων (εκτός του οξυγόνου όπως προαναφέρθηκε) για κάθε ένωση, κάτι που είχε γίνει γενικά αποδεκτό μέχρι τα 1830 και έμενε μόνο στον Liebig (Justus von Liebig, 1803 –1873) να προτείνει στα 1834 ως μια απλούστευση, τον συμβολισμό με αριθμητικό δείκτη δίπλα στο σύμβολο κάθε στοιχείου τον αριθμό των ατόμων του στο κάθε μόριο, δίνοντας στη χημεία την τελική γλώσσα για την έκφρασή της.
Ο Liebig πάντως ευθύνεται, ως ένα βαθμό με τις πρωτοποριακές του μελέτες, για μια περιστασιακή καθυστέρηση στην αποδοχή της ατομικής θεωρίας, που συνδέεται με το φαινόμενο της ισομέρειας.
Στα 1824 παρουσίασε τις παρατηρήσεις του πάνω στα άλατα του άγνωστου τότε φουλμινικού οξέος (HCNO) ενώ ταυτόχρονα ο Wöler εμφάνιζε τα δικά του αποτελέσματα πάνω σε μια επίσης κατηγορία αλάτων, του αγνώστου επίσης ισοκυανικού οξέος (HNCO).
Η προφανής ταύτιση των αποτελεσμάτων των στοιχειακών αναλύσεων για τις δύο κατηγορίες ενώσεων δημιουργούσε πρόβλημα αξιοπιστίας του ενός από τους δύο, αφού οι ενώσεις είχαν κάποιες διαφοροποιήσεις στη χημική τους συμπεριφορά.
Μετά από επανειλημμένες συναντήσεις και συζητήσεις μεταξύ των δύο και μετά από εμπεριστατωμένη ανάλυση των στοιχείων από τον Berzelius, ο τελευταίος διατύπωσε στα 1831 την άποψη πως μπορεί να υπάρχουν ισομερείς ενώσεις, δηλαδή ενώσεις που να έχουν την ίδια στοιχειομετρία αλλά διαφορετικές ιδιότητες, επειδή οι τελευταίες οφείλονται όχι στον αριθμό αλλά στη σχετική διάταξη των ατόμων μέσα στο κάθε μόριο. Για τον Berzelius αυτή ήταν μια ευκαιρία να επεκτείνει τη δυιστική του θεωρία πέρα από τις τυπικά ανόργανες ενώσεις και σ' όλο το φάσμα των οργανικών, αποδεχόμενος ότι στο μοντέλο των ενώσεων που εισηγούνταν, μπορούσαν να συμμετέχουν περισσότερα από δύο είδη ατόμων.
Η αρχική θέση του Dalton όσον αφορά την ατομική θεωρία του είναι πως αποτελούσε το αντίστοιχο της μηχανικής του Newton στη Χημεία.
Συνεπώς, όπως ο Newton με τους νόμους της έλξης είχε δώσει το θεωρητικό υπόβαθρο στους εμπειρικούς νόμους του Keppler για την κίνηση των πλανητών έτσι και η ατομική θεωρία έλυνε το αίνιγμα της ύπαρξης των διάφορων νόμων που πρόσφατα είχαν προταθεί σχετικά με τη σύσταση των χημικών ενώσεων.
Προχωρώντας λίγο περισσότερο ο Berzelius πρότεινε ένα ιδιότυπο ατομιστικό σχήμα για να περιγράψει τη χημεία του καιρού του. Στο σχήμα αυτό η ατομική θεωρία ήταν κεντρική όχι όμως και οι διάφορες ιδιότητες του ατόμου πέρα από το βάρος του.
Ο Berzelius έμεινε στην απεικόνιση των χημικών ενώσεων με τύπους, στους οποίους η παρουσία ενός στοιχείου σήμαινε την παρουσία συγκεκριμένου βάρους του και οι διάφοροι συνελεστές ή τα αντίστοιχα σύμβολα είχαν την έννοια της πολλαπλότητας ενός βασικού στοιχειώδους βάρους του στοιχείου αυτού.
Στη βάση αυτή δημιούργησε τη δυιστική θεωρία του κατά την οποία όλα τα σώματα μπορούν να αποδοθούν με τη μορφή Α+Β-, όπου Α και Β δύο κατάλληλα τμήματα του συνολικού σώματος που περιγράφεται ως ΑΒ. Η ύπαρξη του σώματος ΑΒ αποδίδεται στις ηλεκτροστατικές δυνάμεις μεταξύ των δύο αντίθετα φορτισμένων τμημάτων του. Έτσι, για παράδειγμα ο θειικός χαλκός περιγράφεται ως CuO + SO3 και παραπέρα υπάρχει μια εξέλιξη πολύ σημαντική για την εξέλιξη της σύγχρονης Χημείας.
Ο Berzelius θεωρεί ότι στο θετικό κομμάτι της ένωσης ο θετικός χαλκός συνδέεται με το αρνητικό οξυγόνο, αλλά με τρόπο ώστε το σύνολό τους παραμένει ελαφρώς ηλεκτροθετικό, κάτι που το κάνει ικανό να συνδυαστεί παραπέρα με το ηλεκτραρνητικό κομμάτι SO3.
Με τον τρόπο αυτό γίνεται η εισαγωγή στην εποχή της χρήσης των χημικών τύπων και συγκεκριμένα, στη θεωρία των χημικών ριζών.
H δημιουργία του Περιοδικού πίνακα
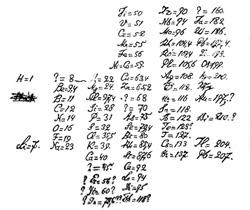
Στη συνέχεια, τη σημαντικότερη προσφορά στον τομέα της θεώρησης του ατόμου και μέσα από αυτό, ολόκληρης της φυσικής επιστήμης, πραγματοποιεί ο Mendeleev (Dmitri Ivanovich Mendeleev 1834-1907) που πρότεινε, στα 1867, τη συστηματική κατάταξη των διαφόρων στοιχείων με ορισμένη σειρά, σε οριζόντιες σειρές, με τέτοιο τρόπο, ώστε να δημιουργούνται κατακόρυφες στήλες που να περιέχουν στοιχεία με παρόμοιες χημικές ιδιότητες.
Παρόμοιες προσπάθειες, προϋπήρξαν, αυτή ήταν όμως η πιο συστηματική, πλήρης όσον αφορά τα υπάρχοντα τότε γνωστά στοιχεία και, κυρίως, δυναμική εφόσον "επέτρεπε" την ανακάλυψη νέων στοιχείων, για μερικά από τα οποία προέβλεψε με ακρίβεια ορισμένες φυσικές και χημικές τους ιδιότητες. Για την ακρίβεια, οι ιδιότητες ορισμένων στοιχείων που ήταν τότε άγνωστα, προτάθηκαν με βάση τις υποτιθέμενες ενδιάμεσες τιμές που έπρεπε να έχουν σε σχέση με τα γειτονικά τους στον πίνακα στοιχεία. Πράγματι, σε σχετικά σύντομο χρονικό διάστημα οι προτάσεις αυτές επαληθεύτηκαν για τα στοιχεία που ακολουθούσαν το Αργίλιο και το Πυρίτιο στις ομάδες 13 και 14 του σύγχρονου πίνακα, όπως αυτές αναφέρονται από την IUPAC.




| Ιδιότητα | εκα-Αργίλιο | Γάλλιο | εκα-Πυρίτιο | Γερμάνιο |
| Ατ. βάρος | 68 | 69,7 | 72 | 72,59 |
| Χρώμα | γκρι | γκριζόλευκο | γκρι | γκριζόλευκο |
| Πυκνότητα (g mL-1) | - | - | 5,5 | 5,47 |
| Επίδραση οξέων | διαλυτό | διαλυτό | καμία | καμία |
| Τύπος οξειδίου | E2Cl3 | Ga2O3 | EkO2 | GeO2 |
| Τύπος χλωριδίου | ECl3 | GaCl3 | EkCl4 | GeCl4 |
Aυτός ο πίνακας περιοδικότητας των στοιχείων, με ελάχιστες τροποποιήσεις και, φυσικά, με τις προσθήκες των νέων στοιχείων, είναι ο χρησιμοποιούμενος μέχρι και σήμερα.
Η προσπάθεια του Mendeleev δεν ήταν ούτε η μόνη ούτε η πρώτη.
Ήδη από το 1789 ο Lavoisier είχε δημοσιεύσει ένα πίνακα με τα 33 τότε γνωστά χημικά στοιχεία.
Ωστόσο αυτός, πιστός στις σκέψεις και τους στόχους του τα κατέταξε σε ομάδες ως αέρια και γαίες ή μέταλλα και μη μέταλλα, ανάλογα δηλαδή με τη φυσική τους κατάσταση και τις βασικές χημικές τους ιδιότητες. Οπωσδήποτε όμως η κατάταξη αυτή δημιούργησε τη βάση για παραπέρα μελέτη όχι μόνο για τον εντοπισμό νέων στοιχείων αλλά και για την ανίχνευση νέων τρόπων κατάταξης των στοιχείων ώστε από αυτήν να προκύπτουν περισσότερα δεδομένα γι αυτά.
Το 1829 ο Johann Wolfgang Döbereiner παρατήρησε πως ορισμένα στοιχεία μπρούσαν να ομαδοποιηθούν σε τριάδες ανάλογα με τις χημικές τους ιδιότητες.
Έτσι για παράδειγμα το λίθιο, το νάτριο και το κάλιο αποτελούσαν μια τριάδα από ελαφρά, μαλακά και πολύ δραστικά μέταλλα. Ακόμη, έκανε την παρατήρηση ότι στις τριάδες που είχε υπόψη του και εφόσον κατέτασσε τα στοιχεία κατά σειρά αυξανόμενου ατομικού βάρους, το μέσο στοιχείο είχε ατομικό βάρος περίπου τον μέσο όρο των ατομικών βαρών των ακραίων στοιχείων. Η παρατήρηση αυτή επιβεβαιώθηκε και από άλλους και έγινε γνωστή ως ο κανόνας των τριάδων.
Στη συνέχεια δίνεται ένα παράδειγμα με δύο από τις πιο γνωστές περιπτώσεις τριάδων με τα σύγχρονα ατομικά βάρη και για το μεσαίο στοιχείο σε παρένθεση δίνεται ο αναμενόμενος μέσος όρος από τα βάρη των ακραίων μελών της τριάδας.
Li 6,94 Na 22,99 (23,02) K 39,10
Cl 35,45 Br 79,90 (81,18) I 126,90
Η προφανής επιτυχία της κατάταξης αυτής έδωσε το έναυσμα για παραπέρα μελέτες και ένας από τους πιο ένθερμους μελετητές, ο Γερμανός Leopold Gmelin ήταν σε θέση, το 1843 να αναφέρει την ύπαρξη δέκα τέτοιων τριάδων στοιχείων, τριών τετράδων και ακόμη μιας ομάδας πέντε στοιχείων. Ακολούθησαν και άλλοι αλλά οι κατηγοριοποιήσεις σε μικρές ομάδες δεν έδιναν τη δυνατότητα στους χημικούς να διευρύνουν την έρευνά τους και κυρίως όσον αφορά την πρόβλεψη των ιδιοτήτων κάποιων στοιχείων. Αφού ήταν ήδη γνωστή και παραδεκτή η ιδιότητα του σθένους κάποιων στοιχείων, ο Julius Lothar Meyer (1864) έκανε μια καταγραφή των 49 γνωστών στοιχείων σύμφωνα με το σθένος τους και παρατήρησε ότι στοιχεία με το ίδιο σθένος εμφάνιζαν παρόμοιες ιδιότητες.
Τέλος και ο Άγγλος John Newlands παρουσίασε κάποιες εργασίες του το 1864 και 1865 όπου κατατάσσοντας τα στοιχεία κατά αυξανόμενο ατομικό βάρος παρατήρησε την ομοιότητα των ιδιοτήτων περίπου κανονικά σε κάθε ένατο στοιχείο. Ωστόσο προσπάθησε να συνδέσει την παρατήρηση της ύπαρξης οκτάδων με τη μουσική και τις αντίστοιχες οκτάβες και για το λόγο αυτό έγινε καταγέλαστος στη Βασικλή Χημική Εταιρεία όπου αρνήθηκαν να δημοσιεύσουν τα αποτελέσματά του.