Η χημική εξίσωση μιας αντίδρασης ενός οξέος, όπως το υδροχλωρικό οξύ (HCl) με ένα δραστικό μέταλλο όπως τον ψευδάργυρο (Zn ), μπορεί να γραφεί με τους παρακάτω διαφορετικούς τρόπους.
1ος τρόπος
Η χημική εξίσωση γράφεται απλά ώστε να φαίνονται μόνο τα αντιδρώντα και τα προϊόντα που μετέχουν στην αντίδραση. Η χημική αυτή εξίσωση λέγεται μοριακή χημική εξίσωσή και για την αντίδραση του υδροχλωρικού οξέος με το μεταλλικό ψευδάργυρο είναι:
![]()
2ος τρόπος
Είναι γνωστό ότι κάποιες ενώσεις μέσα στο νερό αλλά και γενικότερα σε υδατικά διαλύματα διίστανται στα ιόντα τους και υπάρχουν μέσα σε αυτά μόνο ως ιόντα. Επομένως αν ανάμεσα στα προϊόντα ή τα αντιδρώντα μιας αντίδρασης υπάρχουν τέτοιες ενώσεις, μπορεί να γραφεί η χημική εξίσωση γράφοντας τις ενώσεις αυτές με την πραγματική τους μορφή δηλαδη με τη μορφή ιόντων.
Έτσι το ΗCl(aq) γράφεται ως H + (aq) και Cl - (aq) και το ZnCl 2 (aq) ως Zn 2+ (aq) και 2Cl - (aq). Άρα προκύπτει μια πλήρης ιοντική εξίσωση:
![]()
Στην παραπάνω ιοντική εξίσωση τα ιόντα Cl - (aq) εμφανίζονται τόσο στα αντιδρώντα όσο και στα προϊόντα. Τα ιόντα αυτά δε συμμετέχουν στην αντίδραση, είναι απλοί θεατές και μπορούν να διαγραφούν από τα αντιδρώντα και τα προϊόντα.
Έτσι προκύπτει η τελική ιοντική εξίσωση:
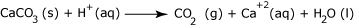
όπου φαίνεται ότι η αντίδραση δεν είναι τίποτε άλλο παρά η αντίδραση των κατιόντων υδρογόνου και του μεταλλικού ψευδαργύρου προς παραγωγή κατιόντων ψευδαργύρου, νερού και αερίου υδρογόνου.