O Svante Αrrhenius όπως και στην περίπτωση των οξέων αναζήτησε την αιτία της εμφάνισης των κοινών ιδιοτήτων των βάσεων στη δομή τους. 
Παρατήρησε ότι έχουν στο μόριο τους μια κοινή ομάδα το υδροξείδιο (ΟΗ) που δεν υπάρχει στα οξέα.
Με βάση αυτή τη διαπίστωση και γνωρίζοντας ότι το νερό μπορεί να διαλύσει πολλές χημικές ενώσεις, με αποτέλεσμα τη διάσταση τους σε ιόντα, ο Αrrhenius πρότεινε ότι:
Βάση είναι κάθε χημική ένωση που όταν διαλύεται στο νερό ελευθερώνει ανιόντα του υδροξειδίου (ΟΗ - ) στο διάλυμα.
Επιπλέον σύμφωνα με τον Arrhenius όσο περισσότερα είναι τα κατιόντα υδροξειδίου (ΟΗ - ) στο διάλυμα, τόσο πιο βασικό είναι.
Προσοχή όμως! Σε καμία περίπτωση δεν σημαίνει ότι όποια χημική ένωση έχει την ομάδα υδροξυλίου (ΟΗ) είναι βάση. Οι ενώσεις που χαρακτηρίζονται ως βάση θα πρέπει επιπλέον να ελευθερώνουν ανιόντα υδροξειδίου (ΟΗ - ) κατά τη διάλυση τους στο νερό.
Για παράδειγμα ενώ η αιθανόλη (CH 3 CH 2 OH) περιέχει στο μόριο της OH, δεν παρουσιάζει βασικό χαρακτήρα. Αυτή είναι μια ακόμα αδυναμία της θεωρίας του Αrrhenius.
Παραδείγματα διάστασης βάσεων στο νερό: 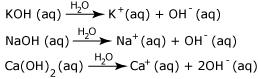
Ενώ για την αμμωνία η διάσταση γίνεται ως εξής:
Η αμμωνία (NH 3 ) κατά τη διάλυση της στο νερό σχηματίζει υδροξείδιο του αμμωνίου (NH 4 OH).
![]()
Στη συνέχεια το υδροξείδιο του αμμωνίου (NH 4 OH) διίσταται στα ιόντα του ΝΗ 4+ και ΟΗ -. ![]()