Οι υδρογονάνθρακες, όπως και πολλές άλλες ενώσεις, οξειδώνονται από το οξυγόνο. Η οξείδωσή τους συνοδεύεται από έκλυση θερμότητας και φως (φλόγα). Μάλιστα, η θερμότητα που παράγεται είναι πολύ μεγάλη σε σχέση με άλλες ενώσεις. Τα προϊόντα της καύσης τους καλούνται καυσαέρια.
Όταν η οξείδωση των υδρογονανθράκων γίνεται παρουσία αρκετού οξυγόνου, η καύση είναι πλήρης και τα προϊόντα, δηλαδή τα καυσαέρια, είναι το διοξείδιο του άνθρακα και το νερό.
Παρακάτω δίνονται οι χημικές εξισώσεις της πλήρους καύσης μερικών υδρογονανθράκων.
|
Mεθάνιο: |
CΗ 4 (g) + 2O 2 (g) 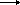 CO 2 (g) +2Η 2 Ο(g) + Θερμότητα CO 2 (g) +2Η 2 Ο(g) + Θερμότητα |
|
Αιθάνιο: |
2C 2 Η 6 (g) + 7O 2 (g) 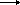 4CO 2 (g) + 6Η 2 Ο(g) + Θερμότητα 4CO 2 (g) + 6Η 2 Ο(g) + Θερμότητα |
|
Προπάνιο: |
C 3 Η 8 (g) + 5O 2 (g) 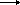 3CO 2 (g) + 4Η 2 Ο(g) + Θερμότητα 3CO 2 (g) + 4Η 2 Ο(g) + Θερμότητα |
|
Βουτάνιο: |
2C 4 Η 10 (g) +13 O 2 (g) 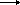 8CO 2 (g) + 10Η 2 Ο(g) + Θερμότητα 8CO 2 (g) + 10Η 2 Ο(g) + Θερμότητα |
|
Αιθένιο: |
C 2 Η 4 (g) + 3O 2 (g) 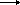 2CO 2 (g) + 2Η 2 Ο(g) + Θερμότητα 2CO 2 (g) + 2Η 2 Ο(g) + Θερμότητα |
|
Προπένιο: |
2C 3 Η 6 (g) + 9O 2 (g) 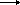 6CO 2 (g) + 6Η 2 Ο (g)+ Θερμότητα 6CO 2 (g) + 6Η 2 Ο (g)+ Θερμότητα |
|
Αιθίνιο: |
2C 2 Η 2 (g) + 5O 2 (g) 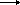 4CO 2 (g) + 2Η 2 Ο(g) + Θερμότητα 4CO 2 (g) + 2Η 2 Ο(g) + Θερμότητα |
| Προπίνιο: | C 3 Η 4 (g) + 4O 2 (g) 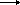 3CO 2 (g) + 2Η 2 Ο(g) + Θερμότητα 3CO 2 (g) + 2Η 2 Ο(g) + Θερμότητα |
Όταν δεν υπάρχει αρκετό οξυγόνο για την πλήρη καύση των υδρογονανθράκων προς CO 2 και Η 2 Ο, η καύση είναι "ατελής" και μπορεί να έχει ως προϊόν το μονοξείδιο του άνθρακα, CO, που είναι τοξικό αέριο, με βάση τη χημική εξίσωση (για το προπάνιο):
2C 3 Η 8 (g)+ 7O 2 (g) 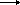 6CO(g) + 8Η 2 Ο(g) + Θερμότητα
6CO(g) + 8Η 2 Ο(g) + Θερμότητα
Με ακόμα λιγότερο οξυγόνο από την ατελή καύση προκύπτει άνθρακας που δίνει και την καπνιά.
C 3 Η 8 (g) + 2O 2 (g) 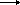 3C(s) + 4Η 2 Ο(g) + Θερμότητα
3C(s) + 4Η 2 Ο(g) + Θερμότητα