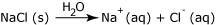Ηλεκτρολύτες ονομάζονται οι χημικές ενώσεις που τα υδατικά τους διαλύματα είναι καλοί αγωγή του ηλεκτρισμού.
Η πειραματική επιβεβαίωση του ηλεκτρολυτικού ρόλου των οξέων γίνεται με την παρακάτω διάταξη (ηλεκτρικό κύκλωμα) η οποία αποτελείται από δύο ηλεκτρόδια γραφίτη (μύτες απο μηχανικό μολύβι), ένα καλώδιο, μια μπαταρία, ένα λαμπάκι και ένα ποτήρι ζέσεως.
Όταν μέσα στο ποτήρι ζέσεως στο οποίο είναι βυθισμένα τα ηλεκτρόδια, υπάρχει απεσταγμένο νερό, το λαμπάκι στο κύκλωμα παραμένει σβηστό. Αυτό γίνεται επειδή το νερό είναι κακός αγωγός του ρεύματος και δεν αφήνει να περάσει το ηλεκτρικό ρεύμα μέσα από τη μάζα του, με αποτέλεσμα το κύκλωμα να μένει ανοιχτό.
Αντίθετα, αν βυθιστούν τα άκρα των δύο αγωγών σε διάλυμα άλατος το λαμπάκι ανάβει. Συνεπώς τα διαλύματα των αλάτων παρουσιάζουν αγωγιμότητα , δηλαδή είναι καλοί αγωγοί του ηλεκτρισμού και επομένως τα άλατα είναι ηλεκτρολύτες.
Πιο συγκεκριμένα τα άλατα, όπως για παράδειγμα το χλωριούχο νάτριο (NaCl), όταν είναι διαλυμένο στο νερό διίσταται σε κατιόντα νατρίου (Να + ) και ανιόντα χλωρίου (Cl - ). Όταν τα άκρα των αγωγών βυθιστούν στο διάλυμα τα ανιόντα κατευθύνονται προς τον θετικό αγωγό και τα κατιόντα προ τον αρνητικό. Έτσι, εφόσον έχουμε μεταφορά φορτίων, από το διάλυμα διέρχεται ηλεκτρικό ρεύμα και συνεπώς το διάλυμα παρουσιάζει αγωγιμότητα.
Όταν τα άκρα των αγωγών βυθιστούν στο διάλυμα τα ανιόντα κατευθύνονται προς τον θετικό αγωγό και τα κατιόντα προ τον αρνητικό. Έτσι, εφόσον έχουμε μεταφορά φορτίων, από το διάλυμα διέρχεται ηλεκτρικό ρεύμα και συνεπώς το διάλυμα παρουσιάζει αγωγιμότητα.