Ένα μέταλλο αντιδρά με οξέα, αν είναι δραστικότερο από το υδρογόνο, κατιόντα του οποίου υπάρχουν στα διαλύματα των οξέων. Aς δούμε τώρα ποια είναι δραστικότερα του υδρογόνου.
Πράγματι, μέταλλα όπως το λίθιο (Li), το μαγνήσιο (Mg), το αργίλιο (Al),το νάτριο (Na), ο σίδηρος (Fe) και ο ψευδάργυρος (Zn) είναι δραστικότερα από το υδρογόνο. Αντίθετα, άλλα, όπως ο χαλκός (Cu), ο άργυρος (Ag), ο χρυσός (Au) και ο λευκόχρυσος (Pt), είναι λιγότερο δραστικά από αυτό. Μερικά από τα τελευταία, όπως ο λευκόχρυσος και ο χρυσός, λέγονται και ευγενή μέταλλα.
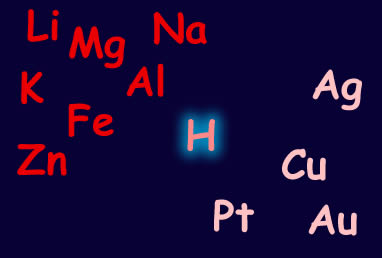
Πως όμως μπορούμε να ξέρουμε αν ένα μέταλλο είναι πιο δραστικό από ένα άλλο; Όσο πιο δραστικό είναι ένα μέταλλο, τόσο πιο έντονη είναι η αντίδρασή του με τα οξέα και, συνεπώς, τόσο μεγαλύτερη είναι η ταχύτητα έκλυσης των φυσαλίδων υδρογόνου.
Με μια τέτοια μελέτη των αντιδράσεων πολλών μετάλλων με οξέα, μπορεί να προκύψει η παρακάτω σειρά δραστικότητας των μετάλλων που είναι δραστικότερα από το υδρογόνο.
Δυστυχώς, με μια τέτοια μελέτη, δε μπορούμε να συγκρίνουμε τη δραστικότητα μεταξύ μετάλλων όπως ο χαλκός, ο άργυρος, ο χρυσός και ο λευκόχρυσος, που είναι λιγότερο δραστικά από το υδρογόνο και δεν αντιδρούν με οξέα.

Για να συγκρίνουμε τη δραστικότητα δύο μετάλλων λιγότερο δραστικών από το υδρογόνο, μελετάμε την αντίδραση του ενός με διάλυμα άλατος του άλλου. Ένα μέταλλο αντικαθιστά ένα άλλο σε ένα διάλυμα άλατός του αν είναι δραστικότερο από αυτό. Έτσι, διαπιστώνουμε τη σχετική τους δραστικότητα.
Έτσι λοιπόν, με ανάλογα πειράματα, οι χημικοί κατέταξαν τα μέταλλα και το υδρογόνο στην παρακάτω σειρά δραστικότητας, που ονομάζεται και ηλεκτροχημική σειρά. Εύκολα τώρα, μπορούμε να προβλέψουμε ότι ο άργυρος (Ag) δεν αντιδρά με υδροχλωρικό ή θειικό οξύ, επειδή είναι λιγότερο δραστικός από το υδρογόνο. Επίσης, αν προσθέσουμε σίδηρο σε διάλυμα άλατος αργύρου, ο σίδηρος θα αντικαταστήσει τον άργυρο στο διάλυμα και ο άργυρος θα αποτεθεί ως καθαρό μέταλλο. Και αυτό επειδή ο σίδηρος είναι δραστικότερος από τον άργυρο.
