Oι υδρογονάνθρακες είναι οι οργανικές ενώσεις που αποτελούνται από άνθρακα και υδρογόνο. Στην ανθρακική αλυσίδα των πιο απλών υδρογονανθράκων, οι άνθρακες ενώνονται μεταξύ τους χρησιμοποιώντας μια μονάδα συγγένειας ο καθένας και χρησιμοποιούν τις υπόλοιπες για να ενωθούν με άτομα υδρογόνου.
Κάντε κλικ στο μόριο του υδρογονάνθρακα για να δείτε πως σχηματίζεται:
Οι υδρογονάνθρακες που είδαμε τώρα είναι μόρια "ευθείας" ανθρακικής αλυσίδας. Αν κάποιοι άνθρακες χρησιμοποιούν δύο ή περισσότερες μονάδες συγγένειας για να ενωθούν με άλλους άνθρακες, τότε προκύπτουν οι υδρογονάνθρακες "διακλαδισμένης" αλυσίδας.
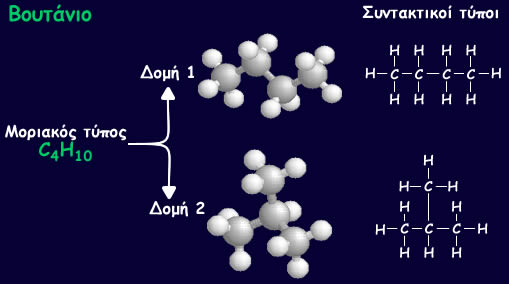
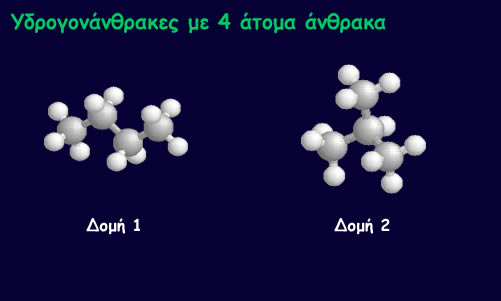
Όπως φαίνεται παρακάτω, από τέσσερα άτομα άνθρακα προκύπτουν δύο υδρογονάνθρακες. Ενας με ευθεία και ένας με διακλαδισμένη αλυσίδα.
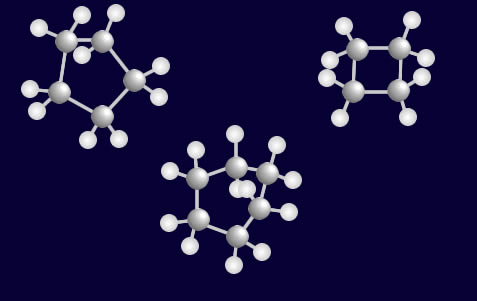
Μέχρι τώρα είδαμε "άκυκλους" υδρογονάνθρακες. Αν η αλυσίδα κλείσει κύκλο σε οποιοδήποτε σημείο, προκύπτουν οι "κυκλικοί" υδρογονάνθρακες. Δες παρακάτω πως δομούνται τρεις από αυτούς.
Στους υδρογονάνθρακες που είδαμε μέχρι τώρα, κάθε άνθρακας χρησιμοποιεί μια μονάδα συγγένειας για να ενωθεί με άλλους και καλούνται "κορεσμένοι". Αν δύο από αυτούς χρησιμοποιήσουν δύο μονάδες ο καθένας, προκύπτει "διπλός δεσμός". Αν χρησιμοποιήσουν τρείς, προκύπτει "τριπλός δεσμός". Οι υδρογονάνθρακες αυτοί, στους οποίους υπάρχει ένας τουλάχιστον διπλός ή τριπλός δεσμός καλούνται "ακόρεστοι".
Σκέψου τώρα, αν αρχίσουμε και αντικαθιστούμε υδρογόνα ή άνθρακες με άτομα στοιχείων όπως Cl, O, N, S κ.α. τι ποικιλία ενώσεων προκύπτει. Αυτές βέβαια θα είναι οργανικές ενώσεις, αλλά όχι υδρογονάνθρακες. Θα ανήκουν σε άλλες τάξεις οργανικών ενώσεων.
Όπως όλες οι χημικές ενώσεις και οι οργανικές συμβολίζονται με το μοριακό τους τύπο. Έτσι, ο κορεσμένος υδρογονάνθρακας με 4 άτομα άνθρακα έχει μοριακό τύπο C 4 H 10 . Τώρα βέβαια ξέρεις ότι υπάρχουν δύο τέτοιοι υδρογονάνθρακες, με ευθεία και διακλαδισμένη αλυσίδα. Για να τους ξεχωρίσουμε χρησιμοποιούμε το συντακτικό τύπο.
Ο πιο παραστατικός τρόπος βέβαια, είναι τα προσομοιώματα των μορίων τους.