Ηλεκτρολύτες ονομάζονται οι χημικές ενώσεις που τα υδατικά τους διαλύματα είναι καλοί αγωγή του ηλεκτρισμού.
Η πειραματική επιβεβαίωση του ηλεκτρολυτικού ρόλου των βάσεων γίνεται με την παρακάτω διάταξη (ηλεκτρικό κύκλωμα) η οποία αποτελείται από δύο ηλεκτρόδια γραφίτη, ένα καλώδιο, μια μπαταρία, ένα λαμπάκι και ένα ποτήρι ζέσεως.
Όταν μέσα στο ποτήρι ζέσεως στο οποίο είναι βυθισμένα τα ηλεκτρόδια, υπάρχει απεσταγμένο νερό, 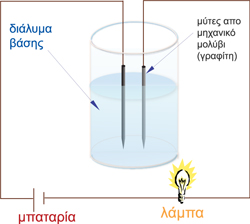 το λαμπάκι στο κύκλωμα παραμένει σβηστό. Αυτό γίνεται επειδή το νερό είναι κακός αγωγός του ρεύματος και δεν αφήνει να περάσει το ηλεκτρικό ρεύμα μέσα από τη μάζα του, με αποτέλεσμα το κύκλωμα να μένει ανοιχτό. Όταν μέσα στο νερό προστεθούν μερικές σταγόνες βάσης όπως το υδροξείδιο του νατρίου (ΝaOH), οπότε στο ποτήρι ζέσεως θα υπάρχει πλέον αραιό διάλυμα υδροξειδίου του νατρίου, το λαμπάκι του κυκλώματος θα ανάψει. Αυτό σημαίνει ότι το κύκλωμα κλείνει, δηλαδή το ηλεκτρικό ρεύμα διαρρέει το υδατικό διάλυμα της βάσης.
το λαμπάκι στο κύκλωμα παραμένει σβηστό. Αυτό γίνεται επειδή το νερό είναι κακός αγωγός του ρεύματος και δεν αφήνει να περάσει το ηλεκτρικό ρεύμα μέσα από τη μάζα του, με αποτέλεσμα το κύκλωμα να μένει ανοιχτό. Όταν μέσα στο νερό προστεθούν μερικές σταγόνες βάσης όπως το υδροξείδιο του νατρίου (ΝaOH), οπότε στο ποτήρι ζέσεως θα υπάρχει πλέον αραιό διάλυμα υδροξειδίου του νατρίου, το λαμπάκι του κυκλώματος θα ανάψει. Αυτό σημαίνει ότι το κύκλωμα κλείνει, δηλαδή το ηλεκτρικό ρεύμα διαρρέει το υδατικό διάλυμα της βάσης.
Επομένως τα υδατικά διαλύματα των βάσεων είναι καλοί αγωγή του ηλεκτρικού ρεύματος και επομένως οι βάσεις είναι ηλεκτρολύτες. Πιο συγκεκριμένα οι βάσεις κατά την διάλυση τους στο νερό δίνουν θετικά ιόντα μετάλλων και αρνητικά ιόντα υδροξυλίου (ΟΗ - ). Τα ιόντα αυτά είναι οι φορείς του ηλεκτρικού ρεύματος μέσα στο διάλυμα της βάσης.![]()
(παράδειγμα διάστασης βάσης στο νερό)